Novo Nordisk ha anunciado que la Agencia estadounidense del medicamento (FDA) ha aprobado Xultophy 100/3.6 como tratamiento, junto con dieta y ejercicio, para mejorar el control glucémico en adultos con diabetes tipo 2, los cuales no han logrado un control adecuado con insulina basal
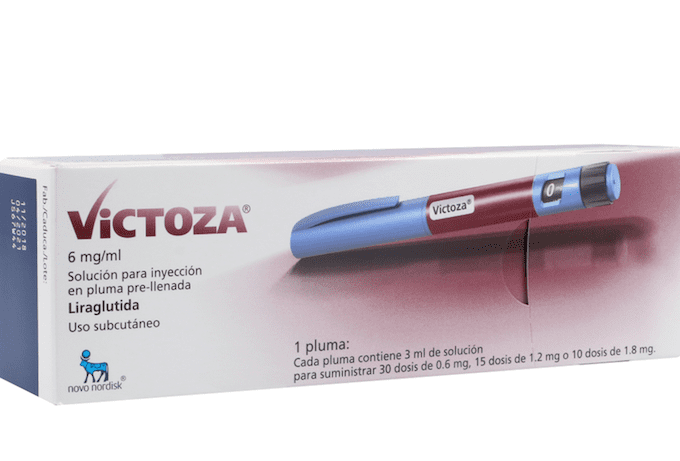
Xultophy 100/3.6, nombre comercial aprobado en EE.UU. para IDegLira, se administra una vez al día en una única inyección que combina insulina degludec (Tresiba), de acción larga, y liraglutida (Victoza), un análogo de GLP-1.
"Estamos muy satisfechos con esta aprobación y esperamos que Xultophy'100/3.6 esté disponible en EE.UU. durante el primer semestre del año que viene", ha señalado Mads Krogsgaard Thomsen, vicepresidente ejecutivo y director médico de Novo Nordisk.
"Creemos que este tratamiento ofrece beneficios significativos y es una importante y conveniente opción de tratamiento, especialmente para las personas que no logran un control glucémico suficiente con la insulina basal", ha asegurado.
La aprobación sigue la recomendación del Comité Asesor de Medicamentos Endocrinológicos y Metabólicos de la FDA, el cual con dieciséis votos a favor y ninguno en contra la aprobó para el tratamiento de adultos con diabetes tipo 2 en su reunión del 24 de mayo de este año.